Scientific Kalender Oktober 2024
Überwachung der DTAH mittels LTA
Wie können Sie die LTA (Lichttransmissionsaggregometrie) zur wirksamen Überwachung der DTHA (duale Thrombozytenaggregationshemmung) einsetzen?
Bestimmung der maximalen Thrombozytenaggregation in % anhand der Konzentration von Arachidonsäure als einzelnem Agonisten
Bestimmung der PT in INR
Bestimmung des APAL- und CPAL-Score
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Wissenschaftliche Hintergrundinformationen
Heute stehen viele Instrumente zur Verfügung, die bei der Beurteilung der Thrombozytenfunktion helfen. Die bewährteste und bekannteste Methode ist die Lichttransmissionsaggregometrie (LTA) nach Born. Diese Messmethode wurde 1963 entwickelt und ist der Goldstandard für Untersuchungen bei hereditären Thrombozytenfunktionsstörungen. [1, 2] Die Messung beruht auf einer Veränderung der Lichttransmission des thrombozytenreichen Plasmas aufgrund von Thrombozytenaktivierung und -aggregation nach Zugabe eines Thrombozyten-Agonisten. [1] Laut Richtlinien ist der Einsatz der LTA allein auf Forschungszwecke beschränkt, aber sie kann auch für die Überwachung der Thrombozytenaggregationshemmung verwendet werden. [3]
Die duale Thrombozytenaggregationshemmung mit Clopidogrel oder einem anderen P2Y12-Inhibitor und Aspirin ist nachweislich eine bewährte Behandlungsstrategie, die laut Richtlinien für Patienten mit kardiovaskulären Erkrankungen empfohlen wird. Es ist bekannt, dass die pharmakologische Wirkung von Thrombozytenaggregationshemmern individuell unterschiedlich ist. Es wurde berichtet, dass viele Personen aufgrund von Polymorphismen des CYP2C19-Gens nicht auf Clopidogrel ansprechen. [4–6] Die thrombozytenaggregationshemmende Wirkung von Aspirin ist bei Patienten mit so genannter „Aspirinresistenz“ aufgrund von Einzelnukleotid-Polymorphismen (SNP), die sich auf COX-1 und die Thrombozytenfunktion auswirken, Entzündung und metabolischem Syndrom reduziert. [7–9]
Dank vollautomatischer Gerinnungs-Analysesysteme der CS-Serie (ohne CS-1600) und der CN-Serie (alle Sysmex Corporation, Kobe, Japan), bei denen manuelle Bedienereingriffe nur in geringem Umfang erforderlich sind und daher die Präzision und Wiederholgenauigkeit der Ergebnisse signifikant verbessert wird, ist die LTA in den letzten Jahren stärker standardisiert worden.
Tabelle 1 LTA unter Verwendung eines halbautomatischen Analysesystems im Vergleich zu Analysesystemen der CS- und CN-Serie
| Halbautomatisch | Arbeitsschritte | CN-/CS-Serie |
| Manuell | Entnahme und Vorbereitung der Blutprobe | Manuell |
| Manuell | Vorbereitung der Rührküvette | Minimiert |
| Manuell | Dosierung der Probe | Automatisch |
| Manuell | Verdünnung des Agonisten | Automatisch* |
| Manuell | Dosierung des Agonisten | Automatisch |
| Automatisch | Aggregationsnachweis | Automatisch |
| Automatisch | Ausgabe des Ergebnisses | Automatisch |
*Nur CN-Serie
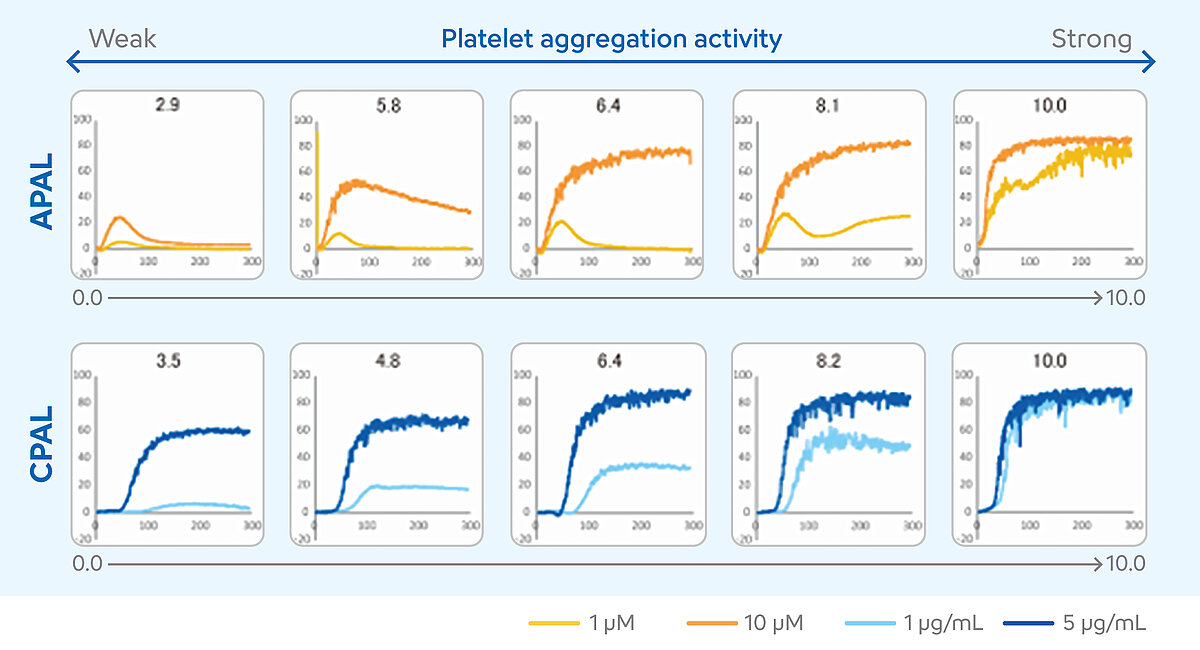
Die Interpretation der LTA-Messergebnisse erfordert ein hohes Maß an Erfahrung. Verschiedene numerische Ergebnisse und der Kurvenverlauf müssen bei der Beurteilung der Einzelfälle berücksichtigt werden. In den letzten Jahren war die LTA bei der Überwachung der dualen Thrombozytenaggregationshemmung (DTAH) daher nur begrenzt einsetzbar. Um dieses Problem zu lösen und die Interpretation der Ergebnisse zu erleichtern, wurde für die Analysesysteme der CS-und CN-Serie die Methode der Konzentration von zwei Agonisten entwickelt. [10] Bei dieser Methode werden die Patientenproben mit zwei Konzentrationen eines Aspirin- und eines P2Y12-Inhibitor-sensitiven Agonisten gemessen. Die Ergebnisse der beiden Konzentrationen werden in einen Score, den Platelet Aggregation Level (PAL) (Thrombozytenaggregation), übersetzt. Anhand dieses Scores kann eingeschätzt werden, ob die DTAH ausreichend wirksam ist oder ob die Therapie des Patienten eventuell angepasst werden muss. Der PAL ist eine Zusatzfunktion des Analysesystems, wobei die Thrombozytenagonisten ADP als P2Y12-Inhibitor-sensitiver Agonist und Kollagen als Aspirin-sensitiver Agonist verwendet werden. Der ADP-induzierte PAL (APAL) wird anhand der Messergebnisse in einer Konzentration von 1 µM und 10 µM und der Kollagen-induzierte PAL (CPAL) anhand der Messergebnisse in einer Konzentration von 1 µg/ml und 5 µg/ml berechnet. Für die Berechnung von APAL und CPAL wird die Fläche unter der Kurve (Area under the curve, AUC) verwendet. [11-13]
Die Scores können im Bereich von 0 bis 10 liegen. Höhere PAL-Score-Werte geben eine höhere Thrombozytenaggreation an, was auf ein schlechtes oder fehlendes Ansprechen auf die DTAH hindeutet. Niedrigere PAL-Score-Werte zeigen eine niedrigere Thrombozytenaggregation und lassen auf ein angemessenes Ansprechen auf die DTAH schließen. [14]
Untersuchungen der PAL-Scores auf Analysesystemen der CS- und CN-Serie ergaben eine Ungenauigkeit unter 5 % bei Proben, denen Aspirin (CPAL) oder der P2Y12-Inhibitor Cangrelor (APAL) zugesetzt wurde, auf einem Analysesystem der CN-Serie und unter 10 % bei Proben mit Zusatz von Cangrelor (APAL) und unter 5 % bei Proben mit Zusatz von Aspirin (CPAL) auf einem Analysesystem CS-5100. Wie in Tabelle 2 zu erkennen, korrelieren die PAL-Ergebnisse gut zwischen beiden Analysesystem-Serien. [14, 15]
Tabelle 2 Korrelation zwischen CN-6000 und CS-5100
| AGONIST | KONZENTRATION | N | R-KOEFFIZIENT | |
| ADP | 1 µM | 85 | 0,988 | y = 1,00x + 3,85 |
| 10 µM | 85 | 0,955 | y = 0,89x + 11,44 | |
| APAL-Score | 85 | 0,971 | y = 0,91x + 0,94 | |
| KOLLAGEN | 1 µg/ml | 82 | 0,996 | y = 1,02x - 0,83 |
| 5 µg/ml | 82 | 0,972 | y = 0,90x + 0,66 | |
| CPAL-Score | 82 | 0,994 | y = 1,00x - 0,08 |
In anderen Studien wurde eine verbesserte Sensitivität des PAL-Systems im Vergleich zur konventionellen Anwendung der LTA ohne Score-System nachgewiesen. Es wurde festgestellt, dass der PAL-Score die Variabilität bei derselben Testperson verringert hat und nachweislich zuverlässiger für die Messung der Wirksamkeit von Thrombozytenaggregationshemmern war als die maximale Thrombozytenaggregation in % in einer Konzentration eines einzelnen Agonisten. [16]
Zurzeit wird weiter geforscht, um die Cut-off-Werte für die Überwachung der Thrombozytenaggregationshemmung unter Verwendung des PAL-Scores zu ermitteln, der das Wiederauftreten thrombotischer Ereignisse während der Therapie idealerweise signifikant reduzieren wird.
Literatur
[1] Born GV. (1962): Aggregation of blood platelets by adenosine diphosphate and its reversal. Nature. 194: 927–929.
[2] Kang J, Park KW, Palmerini T, et al. (2019): Racial Differences in Ischaemia/Bleeding Risk Trade-Off during Anti-Platelet Therapy: Individual Patient Level Landmark Meta-Analysis from Seven RCTs. Thromb Haemost. 119 (1): 149–162.
[3] Cattaneo M, Cerletti C, Harrison P, Hayward CPM, Kenny D, Nugent D, Nurden P, Rao AK, Schmaier AH, Watson SP, Lussana F, Pugliano MT, Michelson AD. (2013): Recommendations for the standardization of light transmission aggregometry: a consensus of the working party from the platelet physiology subcommittee of SSC/ISTH. J Thromb Haemost; 11:1183–1189.
[4] Cattaneo M. (2010): New P2Y(12) inhibitors. Circulation. 121 (1): 171–179.
[5] Bonello L, Tantry US, Marcucci R, et al. (2010): Consensus and future directions on the definition of high on-treatment platelet reactivity to adenosine diphosphate. J Am Coll Cardiol. 56 (12): 919–933.
[6] Tantry US, Bonello L, Aradi D, et al. (2013): Consensus and update on the definition of on-treatment platelet reactivity to adenosine diphosphate associated with ischemia and bleeding. J Am Coll Cardiol. 62 (24): 2261–2273.
[7] Colantonio LD, Gamboa CM, Kleindorfer DO, et al. (2016): Stroke symptoms and risk for incident coronary heart disease in the REasons for Geographic And Racial Differences in Stroke (REGARDS) study. Int J Cardiol. 220: 122–128.
[8] Cattaneo M. (2007): Resistance to antiplatelet drugs: molecular mechanisms and laboratory detection. J Thromb Haemost. 5, Suppl 1: 230–237.
[9] Cattaneo M. (2004): Aspirin and clopidogrel: efficacy, safety, and the issue of drug resistance. Arterioscler Thromb Vasc Biol. 24 (11): 1980–1987.
[10] Matsuo T, Ohki Y. (1977): Classification of platelet aggregation patterns with two ADP solutions (the double-ADP method) and its clinical application to diabetes mellitus. Thromb Res. 11 (4): 453– 461.
[11] Sakayori T, Watanabe Y, Kitano K, et al. (2019): Evaluating the Utility of a Novel Research Use Index in Platelet Aggregation Analysis Featured in an Automated Blood Coagulation Analyzer to Confirm the Effect of Antiplatelet Drugs. Sysmex J Int. 2019; 29 (1): 39–47.
[12] Omori Y, Ishida H, Sakayori T, et al. (2019): Evaluation of Fully Automated Blood Coagulation Analyzer Equipped with a Novel Analysis Method – Antiplatelet Responsive Index –. Rinsho Byori. 67 (3): 205–211.
[13] Sadakata T, Sakayori T, Watanabe Y, et al. (2018): Basic Evaluation of PAL Which is a Research Use Index for Confirming the Effect of Antiplatelet Drugs Installed in the CS Series and Comparison Study with the Index Installed in Existing Instrument. Sysmex J. 2018; 19 (2): 1–10.
[14] Sakayori T, et al. (2024): Analytical Evaluation of Platelet Aggregation Level on a Fully Automated Coagulation Analyzer CN-6000, and a Case Study of an Initial Absorbance of Platelet-rich Plasma. Sysmex Journal International Volume 34 No.1. Published 12 June 2024.
[15] Shimizu M, et al. (2019): Evaluation of a new analysis index of platelet aggregation test using CS-5100 with G-Type on a PRP313M. Japanese Journal of Medical Technology, Volume 68, Issue 3, Pages 501–506.
[16] Lecchi A, Capecchi M, Padovan L, Artoni A, Arai N, Shinohara S, La Marca S, Peyvandi F. (2024): Evaluation of an automated platelet aggregation method for detection of congenital or acquired platelet function defects. Blood Transfus. 22(4):350–359.